پیوند های شیمیایی
پیوند کوالانسی : پیوند اتمی نوعی نیروی ربایش است که اتم های یک ماده را در کنارهم قرار می دهد و پیوند کوالانسی جاذبه اي است كه اتم هاي يك مولكول را كنار هم نگه مي دارد و مولکول های کوچک و بزرگ را به وجود می آورد.
اين پیوندبا به اشتراك گذاشتن دو الكترون لايه ی آخر به وجود می آید. الكترونهاي اشتراكي به هر دو اتم تعلق دارد.مثلا مولكول هيدروژن 2 اتمي است. هر اتم هيدروژن با به اشتراك گذاشتن تنها الكترون خود الكترونهاي لايه خود را كامل مي كند .
به ماده ای که ذره های سازنده ی آن مولکول ها هستند ، ترکیبات مولکولی گفته می شود.
ترکیبات مولکولی به صورت مولکول های مجزا در هر سه حالت جامد ، مایع و گاز وجود دارند و پیوند کوالانسی بین این مولکول ها برقرار است .
یون : ذره ای با بار الکتریکی مثبت و یا منفی که با از دست دادن الکترون ها و یا به دست آوردن آن ها در یک اتم وجود دارد.
یون ها مانند اتم ها خنثی نیستند زیرا برخلاف اتم ها دارای پروتون ها و الکترون های برابری نمی باشند.اگر تعداد پروتون ها بیشتر باشد یون مثبت و اگر تعداد الکترون ها بیشتر باشد یون منفی است.
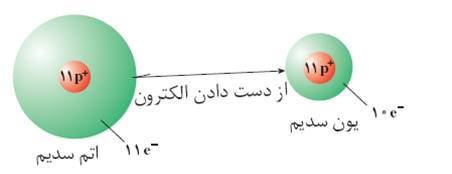
یون مثبت : به اتمی که الکترون از دست بدهد یون مثبت می گویند.مانند اتم سدیم که با از دست دادن الکترون به یون منفی تبدیل می شود.
در شکل اتم سدیم که 11پروتون و 11 الکترون دارد با از دست دادن یک الکترون خود تبدیل به یون سدیم (یون مثبت )با 11پروتون و 10 الکترون شده است.
یون منفی :به اتمی که الکترون از بگیرد یون منفی می گویند. مانند اتم کلر که با ازگرفتن الکترون به یون منفی تبدیل می شود.
در شکل اتم کلر که 17پروتون و 17 الکترون دارد با گرفتن یک الکترون تبدیل به یون کلرید (یون منفی )با 17پروتون و 18 الکترون شده است.
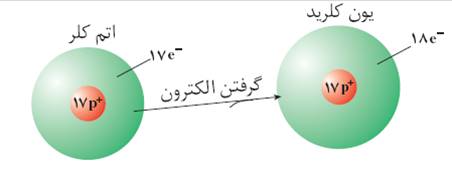
نکته : برای نامیدن یون های منفی پسوند ید به آنها اضافه می گردد. به طور مثال در شکل بالا به یون منفی کلر ، یون کلرید می گویند.
اثر یون ها بر یکدیگر:یون ها نیز مانند قطب های آهنربا عمل می کنند بدین صورت که بارهای همنام همدیگر دفع می کنند و بارهای ناهمنام همدیگر را جذب می کنند.
ترکیبات یونی : به ماده ای که یون های مثبت ومنفی ذره های سازنده ِآن هستند ترکیب یونی گفته می شود.مانند نمک خوراکی یا NaCl
پیوند یونی : نوعی پیوند شیمیایی که یون ها محکم کنار هم نگه داشته است و ترکیبات یونی را به وجود آورده است.
در ترکیبات یونی ، پیوند های یونی به راحتی در آب شکسته می شوند و مولکول های آب سبب جدا شدن این یون ها و پراکنده شدن آن ها در محلول می شوند. بدین ترتیب با پراکنده شدن این ذرات رسانایی الکتریکی محلول تغییر می کند.به محلول حاصل الکترولیت می گویند.
مقایسه ترکیبات مولکولی با ترکیبات یونی
|
تركيبات يوني |
تركيبات مولكولي
|
|
با انتقال الكترون تشكيل مي شوند |
با به اشتراك گذاشتن الكترون تشكيل مي شوند |
|
نقطه ذوب و جوش بالا دارند |
نقطه ذوب و جوش كمتري دارد |
|
اكثراً در آب حل مي شوند |
اكثرا درآب حل نمي شوند |
|
در حالت محلول يا مذاب رسانا هستند |
هادي الكتريسيته نیستند |
|
نيروي بين ذرات تشكيل دهنده آن قوي تر است |
جاذبه بين اتمهاي مولكول قوي اما جاذبه بين مولكول ها ضعيف است. |
نظرات شما عزیزان:
برچسبها: